Los compuestos iónicos y moleculares: propiedades y estructura, así como su importancia, en diferentes ámbitos.
Procesos de desarrollo de aprendizajes:
Analiza la formación y estructura de compuestos iónicos y moleculares, a partir de las propiedades de la Tabla periódica.
Experimenta y diferencia los compuestos iónicos y moleculares, a partir de las propiedades identificadas en actividades experimentales; elabora conclusiones, inferencias y predicciones en base a la evidencia obtenida.
¿Qué vamos aprender?
Conoceremos que el enlace químico se forma entre átomos de elementos diferentes o iguales, dando lugar a los compuestos iónicos o moleculares (covalentes). Así mismo conoceremos la importancia del estudio de las características de los compuestos con diferentes tipos de enlace, como también entenderemos que es necesario conocer la forma química por la que se forman los enlaces.
Compuestos iónicos y moleculares
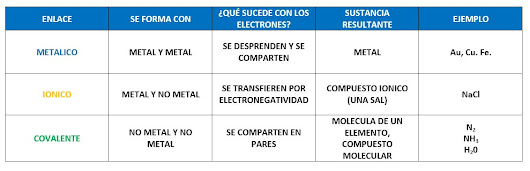
Recordemos que los enlaces químicos son fuerzas que unen a los átomos entre sí para formar moléculas o compuestos.
Ya sabemos que existen tres tipos de enlaces químicos
El enlace químico se lleva a cabo por la interacción de los electrones de valencia de los átomos involucrados.
Enlace iónico.
El enlace iónico se presenta con la atracción electrostática de átomos que poseen cargas eléctricas de signos contrarios (+, -) llamados iones, es este enlace un átomo pierde un electrón mientras que un segundo átomo lo gana; el resultado es que un átomo queda con carga positiva y otro con negativa, por lo que las cargas contrarias se atraerán formando el enlace.
Observa y toma nota del siguiente video:
Ver pagina 262 de tu libro de texto. Tabla de electronegatividad.
Para identificar un enlace iónico solo basta con saber la diferencia de electronegatividad entre los dos átomos unidos. si la diferencia de electronegatividad s mayor a 1.7 se tratará de un enlace iónico.
¿Qué es un ion? aniones y cationes
Los iones se forman cuando un átomo pierde o gana electrones. Los aniones tienen más electrones que protones y los cationes tienen un número de protones más alto.
Se denomina anión al ion que tiene carga eléctrica negativa
Se denomina catión al ion que tiene carga eléctrica positiva
Enlace covalente.
Observa con atención el siguiente video.
El enlace covalente es la unión química entre dos átomos que comparten electrones. Esto hace que los átomos se comporten como una unidad que llamamos molécula.
Los átomos interactúan entre sí por medio de los electrones más externos o de valencia formando enlaces.
El enlace covalente se puede clasificar atendiendo 3 aspectos.
1. Del numero de electrones compartidos.
Enlace covalente sencillo. Se comparten dos electrones.
Enlace covalente doble. se comparten 4 electrones.
Enlace covalente triple. Se comparten seis electrones.
2. Diferencia de electronegatividad.
Si entre los dos átomos enlazados la diferencia de electronegatividad va de 0 a 0.4 se trata de un enlace covalente no polar o puro. (la electronegatividad se toma de nuestro libro de texto de la tabla de pagina262.
Si la diferencia de electronegatividad va de 0.5 a 1.7 se trata de un enlace covalente polar
3. Numero de electrones aportado por átomo.
Si cada átomo aporta el mismo numero de electrones se trata de un enlace covalente normal.
Si un átomo aporta electrones y otro no, se trata de un enlace covalente coordinado o dativo. Observa con mucha atención.
Para recordar:





















No hay comentarios.:
Publicar un comentario