Aprendizaje esperado. Representa la formación de compuestos en una reacción química sencilla, a partir de la estructura de Lewis.
¿Qué vamos a aprender?
Utilizarás la estructura de Lewis que revisaste en sesiones anteriores para representar las uniones entre átomos.
Conocerás algunas reglas para construir Estructuras de Lewis
¿Qué hacemos?
Hasta el momento ya sabemos como se forman los enlaces químicos, los tipos de enlaces químicos y su clasificación, ahora vamos a construir estructuras de Lewis para varios compuestos sencillos.
Las Estructuras de Lewis son estructuras electrónicas que representan moléculas en las cuales cada átomo adquiere la configuración electrónica de un gas noble. para que se cumpla la regla del octeto.
Reglas para construir Estructuras de Lewis
REGLA 1. Debe establecerse una estructura lo mas simétrica posible con los átomos que nos indica la formula molecular.
REGLA 2. Para lograr la mayor simetría posible, se debe colocar como átomo central el átomo menos electronegativo. Para saber la electronegatividad de los elementos quimicos consultar la pagina 262 de tu libro de texto.
Excepción de la REGLA 2
El Hidrogeno nunca puede ser un átomo central.
REGLA 3. Cuando en la formula molecular existan hidrógenos y oxígenos, éstos átomos siempre van unidos formando grupos O-H
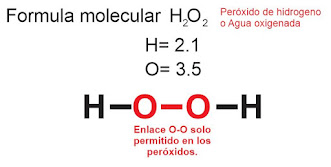
REGLA 4. Debe evitarse el enlace O-O (oxigeno-oxigeno) a excepción de un peróxido.
REGLA 5. Los elementos del Grupo VII A, es decir los halógenos, tienen 7 electrones de valencia y solo llegan a formar un enlace sencillo, si llegan a formar mas enlaces, éstos serán coordinados o dativos (Repasa que es un enlace coordinado o dativo)
REGLA 6. El oxigeno puede presentar 3 tipos de enlace:
1. Dos enlaces sencillos
3. Un enlace coordinado o dativo
Todos los elementos del Grupo VI A, (O, S, Se, Te, Po, Lv) Se comportan como el oxigeno. Si se presentan mas de dos enlaces, los adicionales serán coordinados o dativos.
REGLA 7. Los elementos del grupo VA, tienen 5 electrones de valencia y pueden formar:
1. Tres enlaces sencillos.
2. Un enlace sencillo y un enlace doble.
3. Un enlace triple.
4. Si forman mas de tres enlaces, éstos serán coordinados o dativos.
REGLA 8. El carbono y todos los elementos del grupo IVA, pueden formar:
1. 4 enlaces sencillos.
2. un enlace doble y dos enlaces sencillos.
3. Un enlace triple y y un enlace sencillo
4. dos enlaces dobles.
5. Los elementos del grupo IVA, no forman enlaces coordinados o dativos.
Actividad. Construye las estructuras de Lewis para los siguientes compuestos




















No hay comentarios.:
Publicar un comentario